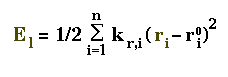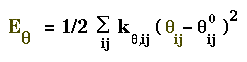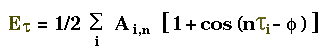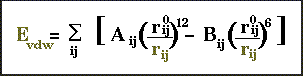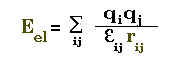CADCOM/MANUEL D'UTILISATION
Champs de Force
Un champs de force est un fichier de données décrivant les interactions
entre atomes liés et non liés.
L'élaboration d'un champs de force doit répondre à 2 critéres.
.simplicité pour pouvoir être calculée rapidement
.précision pour calculer de maniére acceptable les propriétés
structurales et thermodynamiques des molécules.
De tels champs de force sont apparus dés 1970 et continuent à
évoluer aujourdhui.
 les interactions entre atomes liés correspondent à des énérgies
de déformation des liaisons,des angles de valence et
de torsion des angles diédres.
les interactions entre atomes liés correspondent à des énérgies
de déformation des liaisons,des angles de valence et
de torsion des angles diédres.
 les interactions entre atomes non liés correspondent aux
interactions de Van der Waals,électrostatiques,liaisons Hydrogéne.
les interactions entre atomes non liés correspondent aux
interactions de Van der Waals,électrostatiques,liaisons Hydrogéne.
A) Atomes liés
La combinaison des interactions entre atomes liés est
appelé champs de force de valence.
 Elongation des liaisons("Stretching")
La déformation des liaisons est en général faible(de l'ordre de
0.05Ang) et est exprimée par la fonction au carré("cubique")
suivante.
Elongation des liaisons("Stretching")
La déformation des liaisons est en général faible(de l'ordre de
0.05Ang) et est exprimée par la fonction au carré("cubique")
suivante.
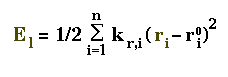
 Déformation des angles("Bending")
La déformation des angles est également faible(de l'ordre de
quelques deg) et est exprimée par la fonction au carré("cubique")
suivante.
Déformation des angles("Bending")
La déformation des angles est également faible(de l'ordre de
quelques deg) et est exprimée par la fonction au carré("cubique")
suivante.
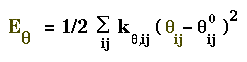
 Torsion des angles diédres("Torsion")
La définition de l'angle de torsion est si on assume les atomes co-planaires
A---B A---B
| = 0.0 | = 180.0
| |
D---C C---D
La torsion des angles diédres pour 4 atomes ABCD
(rotation autour de la liaison BC)est décrite par une fonction
périodique développée en série de Fourrier
Torsion des angles diédres("Torsion")
La définition de l'angle de torsion est si on assume les atomes co-planaires
A---B A---B
| = 0.0 | = 180.0
| |
D---C C---D
La torsion des angles diédres pour 4 atomes ABCD
(rotation autour de la liaison BC)est décrite par une fonction
périodique développée en série de Fourrier
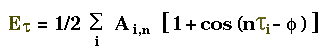
A) Atomes non liés
 Interactions de Van der Waals
L 'énergie de Van der Waals entre 2 atomes i,j distants de rij
comprend:
. Un terme attractif variant en -1/rij**6.Cette fonction
est connue sous le nom d'énergie de dispersion de London
E disp=-Cij/rij**6
Les coefficients Cij sont établis pour les différentes
paires d'atomes présents dans la molécule.
. Un terme répulsif variant en en 1/rij**12,traduisant
le recouvrement des nuages éléctroniques à courtes
distances
Cette fonction (Lennard-Jones) est couramment appelée
potentiel 6-12
Interactions de Van der Waals
L 'énergie de Van der Waals entre 2 atomes i,j distants de rij
comprend:
. Un terme attractif variant en -1/rij**6.Cette fonction
est connue sous le nom d'énergie de dispersion de London
E disp=-Cij/rij**6
Les coefficients Cij sont établis pour les différentes
paires d'atomes présents dans la molécule.
. Un terme répulsif variant en en 1/rij**12,traduisant
le recouvrement des nuages éléctroniques à courtes
distances
Cette fonction (Lennard-Jones) est couramment appelée
potentiel 6-12
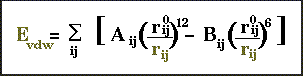
 Interactions électrostatiques.
Interactions électrostatiques.
 Calcul Charge-Charge
L'énergie électrostatique entre 2 atomes ij de charges qi et qj
est représentée par la loi de Coulomb
Calcul Charge-Charge
L'énergie électrostatique entre 2 atomes ij de charges qi et qj
est représentée par la loi de Coulomb
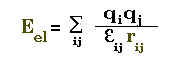 La cte diélectrique prend en général des valeurs de 2 à 4(1.5
couramment).Dans certains programmes elle peut également varier
en 1/rij.
La cte diélectrique prend en général des valeurs de 2 à 4(1.5
couramment).Dans certains programmes elle peut également varier
en 1/rij.
 Calcul Dipole-Dipole
Calcul Dipole-Dipole
 Energie des liaisons hydrogénes.
La liaison Hydrogéne est une interaction de 2 à 5 Kcal/mole
d'importance.
Elle s'exerce entre un Hydrogéne déficient en électrons et
un atome de forte densité électronique(comportant des
doublets).
Energie des liaisons hydrogénes.
La liaison Hydrogéne est une interaction de 2 à 5 Kcal/mole
d'importance.
Elle s'exerce entre un Hydrogéne déficient en électrons et
un atome de forte densité électronique(comportant des
doublets).


Webmaster:
Last
revised:05/2000